GxP Compliance mit QM-Software von roXtra
Ihr Qualitätsmanagement: konform mit EU-GMP, GAMP 5, ISO 13485 und weiteren Richtlinien
GxP Compliance mit roXtra Software
Ihr Qualitätsmanagement: konform mit EU-GMP, GAMP 5, ISO 13485 und weiteren Richtlinien
 |  |  |  |  |  |
 |  |  |
Bewährte Funktionen für den Einsatz im GxP-regulierten Umfeld
Zugriffs- und Benutzerverwaltung
roXtra ermöglicht eine rollenbasierte Rechtevergabe und stellt sicher, dass nur autorisierte Nutzer auf qualitätsrelevante Inhalte zugreifen können. Die Zugriffe sind dokumentiert und nachvollziehbar.
- Rollen- und rechtebasiertes Zugriffssystem
- Nachvollziehbarkeit von Benutzeraktivitäten
- Integration mit Active Directory oder SSO (optional)
Entdecken Sie roXtra
Lernen Sie unser System in einer unverbindlichen und kostenlosen Online-Präsentation kennen.
Häufige Fragen zur Softwarevalidierung
Was bedeutet Softwarevalidierung im GxP-Umfeld?
Die Softwarevalidierung ist der dokumentierte Nachweis, dass ein Softwaresystem im vorgesehenen Anwendungsumfeld zuverlässig und regelkonform funktioniert – ein zentraler Bestandteil der GxP Compliance.
Der Begriff Validierung wird in regulierten Branchen auch für Herstellungsprozesse, Reinigungsverfahren oder Analysen verwendet – bei Software bezieht er sich auf die konforme und nachvollziehbare Systemfunktionalität.
Kurz gesagt: Mit der Validierung stellen Sie sicher, dass Ihre Software exakt das tut, was sie gemäß Spezifikation tun soll – verlässlich, reproduzierbar und GxP-konform.
Warum muss Software validiert werden?
Verschiedene Vorschriften wie AMWHV, MPV, ISO 13485 und der EU-GMP-Leitfaden fordern die Validierung von Software in regulierten Bereichen. Diese Anforderung dient der Risikominimierung, dem Patientenschutz und der lückenlosen Rückverfolgbarkeit.
Durch die Softwarevalidierung wird nachgewiesen, dass computergestützte Systeme sicher, zuverlässig und entsprechend ihrer Spezifikation funktionieren – ein zentraler Aspekt der GxP Compliance.
Vereinfacht gesagt: Software ist ein kritisches Werkzeug. Nur durch regelmäßige Validierung lässt sich sicherstellen, dass es korrekt eingesetzt wird – vergleichbar mit der Wartung technischer Geräte.
Welche Software muss validiert werden?
Nicht jede Software im Unternehmen unterliegt der Validierungspflicht. Laut GxP-Regularien müssen nur solche Systeme validiert werden, die unmittelbaren Einfluss auf produktrelevante Prozesse oder die Erbringung regulierter Dienstleistungen haben.
Die Softwarevalidierung folgt dabei einem risikobasierten Ansatz: Systeme wie E-Mail- oder Betriebssysteme erfordern in der Regel keine Validierung – im Gegensatz zu qualitätskritischer Software, etwa zur Steuerung von Herstellungsprozessen.
Wer ist für die Softwarevalidierung verantwortlich?
Laut GxP-Regularien liegt die Verantwortung für die Softwarevalidierung beim Anwender – also beim Unternehmen, das die Software in einem regulierten Umfeld einsetzt. Sie sind verpflichtet nachzuweisen, dass das System für den vorgesehenen Zweck geeignet ist.
Der Hersteller kann jedoch bei der Validierung unterstützen – etwa durch Musterdokumentationen, Validierungshilfen oder Beratung.
Mehr dazu im Abschnitt: „Unterstützt mich die Roxtra GmbH bei der Softwarevalidierung?”
Wann ist eine Software zu validieren – und wann zu revalidieren?
Die Softwarevalidierung muss vor dem ersten produktiven Einsatz erfolgen – das fordern Regularien wie die DIN EN ISO 13485:2016 (Kap. 4.1.6). Bei Änderungen am System ist eine Revalidierung notwendig. Doch nicht jede Änderung erfordert eine vollständige Validierung. Entscheidend ist die Risikobewertung:
- Major-Updates (z. B. roXtra 8 → 9) bringen meist tiefgreifende Änderungen und erfordern eine vollständige Revalidierung.
- Minor-Updates (z. B. 9.20.0 → 9.22.0) können u. U. mit einer gezielten Teil-Revalidierung ausreichend abgedeckt werden.
Auch Änderungen im Einsatzbereich – etwa der Rollout in neue Unternehmensbereiche – können eine Revalidierung auslösen.
Tipp: Die Kriterien und Abläufe für künftige Revalidierungen sollten bereits im Rahmen der ersten Validierung festgelegt werden. Orientierung bieten u. a. die Releasenotes im System (z. B. unter Hilfe > Allgemein > Releasenotes in roXtra).
Unterstützt mich die Roxtra GmbH bei der Softwarevalidierung?
Ja – mit roXtra setzen Sie auf eine bewährte und GxP-konforme QM-Software, die bereits bei zahlreichen Kunden in stark regulierten Branchen – von Pharmaunternehmen bis hin zu Medizinprodukteherstellern – seit vielen Jahren erfolgreich im Einsatz ist. Als Softwareanbieter sorgen wir dafür, dass roXtra bereits vor der Auslieferung intensiv getestet wird und Ihnen als validierungsfreundliche Standardlösung zur Verfügung steht. So können Sie den Validierungsaufwand in Ihrem Unternehmen deutlich reduzieren.
Zusätzlich stellen wir Ihnen eine praxisorientierte Musterdokumentation bereit, die den Validierungsprozess – vom Validierungsplan bis zum Validierungsbericht – exemplarisch abbildet. Das gibt Ihnen eine strukturierte Grundlage für Ihre eigene Dokumentation. Mit Roxtra haben Sie einen verlässlichen und erfahrenen Partner an Ihrer Seite, der die Anforderungen im GxP-regulierten Umfeld versteht – und Sie dabei unterstützt, Ihre Softwarevalidierung effizient und sicher umzusetzen.
Was beinhaltet eine Software-Validierung?
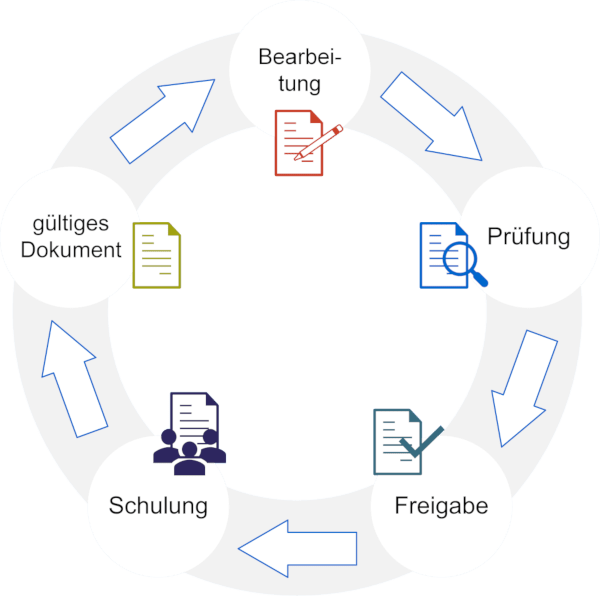
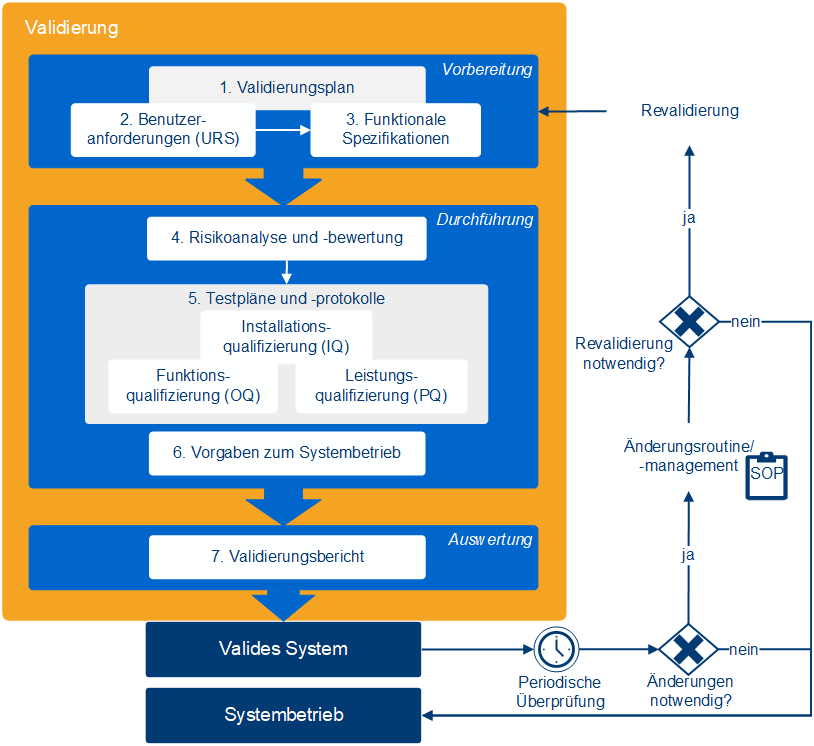
Eine Softwarevalidierung besteht aus mehreren dokumentierten Schritten, mit denen die Eignung eines Systems für den geplanten Einsatz im GxP-regulierten Umfeld nachgewiesen wird. Dabei geht es nicht nur um Tests, sondern auch um Anforderungen, Risiken, Verantwortlichkeiten und betriebliche Vorgaben. Ziel ist es, die Funktionalität, Nachvollziehbarkeit und Compliance des Systems umfassend abzusichern.
Dazu gehören:
- Validierungsbericht: Dokumentation der Ergebnisse und formale Freigabe
- Validierungsplanung: Definition von Zweck, Umfang und Zuständigkeiten
- Anforderung & Spezifikation: Abgleich zwischen Benutzeranforderungen und Systemfunktionen
- Risikobewertung: Analyse potenzieller Risiken und geeigneter Gegenmaßnahmen (z. B. Tests, Schulungen)
- Betriebsvorgaben: Revalidierungskriterien, Backup-Regelungen, Notfallmaßnahmen
Weitere Informationen zur GxP Compliance mit roXtra
Die Richtlinien der guten Arbeitspraxis (GxP)
Warum roXtra GxP?
Für Unternehmen in regulierten Branchen wie Medizin, Pharmazie oder pharmazeutischer Chemie ist der Einsatz konformer und geprüfter Systeme essenziell. Mit roXtra GxP erhalten Sie eine GxP-konforme Standardlösung, die strengen nationalen und internationalen Anforderungen gerecht wird – und gleichzeitig den Qualifizierungs- und Validierungsaufwand deutlich reduziert.
Ob beim Aufbau, der Pflege oder Weiterentwicklung Ihres QM-Systems: roXtra GxP und das erfahrene Team der Roxtra GmbH unterstützen Sie dabei, ein effizientes, regelkonformes und zukunftssicheres Qualitätsmanagement umzusetzen.
Wozu dienen GxP-Richtlinien – und was bedeutet das für Ihre Software?
Die Richtlinien der guten Arbeitspraxis (GxP) stellen hohe Anforderungen an Prozesse, Produkte – und eingesetzte Software. Ziel ist stets die Sicherheit von Patienten, Anwendern und Verbrauchern. Ob GMP (Good Manufacturing Practice), GLP (Good Laboratory Practice) oder GDP (Good Distribution Practice) – alle Bereiche erfordern eine durchgängige Überwachung und Dokumentation produktrelevanter Einflüsse.
Unsere Softwarelösungen unterstützen Sie bei der Einhaltung gesetzlicher Vorgaben wie dem AMG, MPG, 21 CFR Part 11, sowie bei der Umsetzung von Normen wie ISO 9001, DIN EN ISO 13485 und regulatorischen Standards wie dem EU-GMP-Leitfaden (Annex 11, 15), GAMP 5, FDA-Richtlinien, CE-Kennzeichnung und Rili-BÄK.
👉 Erfahren Sie hier, wie konkrete GxP-Anforderungen mit roXtra umgesetzt werden.
Was bedeutet GxP Compliance?
GxP Compliance steht für die Einhaltung branchenspezifischer Qualitäts- und Sicherheitsstandards in regulierten Bereichen wie Pharma, Medizintechnik und Biotechnologie. Das „GxP“ umfasst Richtlinien wie GMP (Herstellung), GLP (Labor) und GCP (klinische Studien).
Ziel ist es, durch dokumentierte, nachvollziehbare Prozesse die Qualität von Produkten und die Integrität von Daten sicherzustellen – häufig mithilfe GxP-konformer QM-Software.
Was sind GxP-Richtlinien – und was bedeutet GxP-Konformität?
GxP-Richtlinien sind regulatorische Vorgaben, die in stark regulierten Branchen wie Pharma und Medizintechnik sicherstellen, dass Produkte wirksam, sicher und qualitätsgesichert sind. „GxP“ steht dabei für verschiedene „Good Practice“-Standards – z. B. GMP, GLP, GCP oder GVP.
GxP-Konformität (auch: GxP Compliance) bedeutet, dass Unternehmen diese Standards einhalten – durch dokumentierte, nachvollziehbare und auditierbare Prozesse. Sie ist entscheidend für Zulassungen, Audits und den rechtskonformen Einsatz von QM-Software in regulierten Umgebungen.
Was bedeutet GxP in der Pharmazie?
GxP in der Pharmazie umfasst alle gesetzlichen Qualitätsrichtlinien, die bei der Entwicklung, Herstellung, Prüfung und Lagerung von Arzneimitteln eingehalten werden müssen – z. B. GMP (Good Manufacturing Practice) oder GCP (Good Clinical Practice).
Diese Vorgaben sichern Produktsicherheit, Wirksamkeit und Rückverfolgbarkeit und sind unerlässlich für Zulassungen, Inspektionen und GxP Compliance im pharmazeutischen Umfeld. Besonders in der GxP Pharma-Branche bilden sie die Grundlage für regulatorisch einwandfreie Prozesse und ein nachhaltiges Qualitätsmanagement.
Wir zeigen Ihnen roXtra in einer kostenlosen und unverbindlichen Online-Präsentation.