Das QM-System für Medizinprodukte:
Ihre effiziente Softwarelösung
QM-System für Medizinprodukte: Ihre Softwarelösung
Success Stories
Erfahren Sie aus erster Hand, wie Medizinproduktehersteller roXtra nutzen, um ihre Qualitätsmanagementsysteme (QMS) effizient und regelkonform zu gestalten. Ob ISO 13485, MDR, FDA-Regularien oder ein umfassendes Risikomanagement – roXtra bietet Lösungen, die speziell auf die Anforderungen der Medizintechnik abgestimmt sind.
In unserem Blog erfahren Sie mehr über die Zertifizierung und Re-Zertifizierung, die Umsetzung von Qualitätsmanagement in der Medizintechnik sowie über praxisnahe Anwendungsbeispiele aus der Branche.
Jetzt beraten lassen
Lernen Sie roXtra in einer unverbindlichen und kostenlosen Online-Präsentation kennen.
Was ist ein Qualitätsmanagementsystem (QMS) für Medizinproduktehersteller?
Ein Qualitätsmanagementsystem (QMS) für Medizinproduktehersteller organisiert und überwacht alle qualitätsbezogenen Prozesse, um die Einhaltung gesetzlicher und regulatorischer Vorgaben wie ISO 13485, MDR und FDA-Regularien sicherzustellen. Es umfasst die Dokumentenlenkung, das Risikomanagement, die Prozesssteuerung und die Durchführung von Audits.
Ziel ist es, die Produktqualität und Sicherheit zu gewährleisten, Risiken zu minimieren und kontinuierliche Verbesserungen umzusetzen. Ein QM-System ist unverzichtbar, um Medizinprodukte effizient herzustellen, Marktzulassungen zu sichern und das Vertrauen von Kunden sowie Behörden zu stärken.
Müssen Medizinproduktehersteller ein QM-System nachweisen?
Ja, Medizinproduktehersteller müssen ein Qualitätsmanagementsystem (QM-System) nachweisen, da dies eine Voraussetzung für die Marktzulassung ist. In der EU verlangt die MDR ein QM-System gemäß ISO 13485, während in den USA die FDA die Einhaltung der 21 CFR Part 820 vorschreibt. Ein QM-System gewährleistet die Sicherheit, Wirksamkeit und Konformität von Produkten durch klar definierte Prozesse wie Dokumentenlenkung, Risikomanagement und Rückverfolgbarkeit. Der Nachweis erfolgt in der Regel durch eine Zertifizierung durch eine benannte Stelle, die für den Zugang zu regulierten Märkten unerlässlich ist.
Was ist laut der ISO 13485 Ziel eines QM-Systems?
Die ISO 13485 beschreibt die Anforderungen an ein Qualitätsmanagementsystem (QMS) speziell für Hersteller und Zulieferer von Medizinprodukten. Ziel ist es, die Sicherheit und Wirksamkeit von Medizinprodukten sicherzustellen, indem sämtliche qualitätsrelevanten Prozesse systematisch gesteuert und überwacht werden.
Welche Vorteile bietet eine Software für das QM-System?
Eine QMS-Software optimiert Prozesse, steigert Effizienz und stellt Regelkonformität sicher. Sie automatisiert Dokumentenlenkung, Auditplanung und CAPA-Maßnahmen, unterstützt Normen wie ISO 13485 und MDR und sorgt für vollständige Nachvollziehbarkeit. Durch flexible Workflows, systematische Datenauswertung und standardisierte Abläufe reduziert sie Fehler, spart Kosten und fördert die kontinuierliche Verbesserung (KVP). Ein unverzichtbares Werkzeug für Qualität und Compliance in der Medizintechnik.
Hilft mir eine QM-Software im Audit?
Ja, eine QM-Software unterstützt Sie umfassend bei der Planung, Durchführung und Nachbereitung von Audits. Sie erleichtert die Erstellung von Auditplänen und Checklisten, ermöglicht die digitale Erfassung von Feststellungen und dokumentiert Nichtkonformitäten direkt im System. Mit automatisierten Berichten und der Verknüpfung von Maßnahmen wie CAPA (Corrective and Preventive Actions) behalten Sie den Überblick und stellen sicher, dass alle Abweichungen fristgerecht bearbeitet werden. Zudem sorgt die Software für eine lückenlose Nachvollziehbarkeit und hilft, regulatorische Anforderungen wie ISO 13485, MDR oder 21 CFR Part 11 effizient zu erfüllen. So steigern Sie die Effektivität Ihrer Audits und sparen wertvolle Zeit.
Eine Software, viele Anwendungsbereiche.
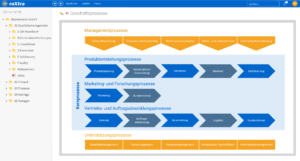
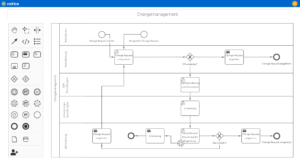
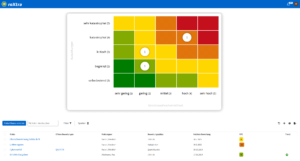
Unterstützung für Qualitätsmanagement und Zertifizierungen in der Medizintechnik
Unsere Softwarelösungen erleichtern Ihnen sowohl den täglichen Betrieb als auch die Zertifizierung und Re-Zertifizierung Ihres Qualitätsmanagementsystems (QMS). Mit roXtra setzen Sie eine Vielzahl von Normen und Verordnungen effizient und regelkonform um – von der DIN EN ISO 13485 bis zur ISO 27001.
Qualitätsmanagement in der Medizintechnik
- DIN EN ISO 13485: Qualitätsmanagement für Medizinprodukte
- MDR (Medical Device Regulation) und MDD (Medical Device Directive): EU-Vorschriften für Medizinprodukte
- Medizinproduktegesetz (MPG): Gesetzliche Anforderungen für Medizinprodukte
- FDA-Regularien: Qualitätsmanagement für Medizinprodukte in den USA
- Medizinprodukte-Betreiberverordnung (MPBetreibV): Anforderungen für Errichten, Betreiben und Anwenden von Medizinprodukten
- G-BA-Ansprüche: Richtlinien des Gemeinsamen Bundesausschusses
Risikomanagement und Sicherheit
- DIN EN ISO 14971 / OE 14971: Anwendung des Risikomanagements auf Medizinprodukte
- DIN EN ISO 31000: Leitlinien für effektives Risikomanagement
- ONR 49000 / ONR 49001: Österreichische Risikomanagement-Normen
- IEC 80001: Risikomanagement bei vernetzter Medizintechnik
- KonTraG und § 91 Abs. 2 AktG: Einrichtung eines Risikomanagementsystems (RMS) für börsennotierte Unternehmen
Qualitätsmanagement allgemein
- DIN EN ISO 9000-Normenreihe: Qualitätsmanagement-Standards
- DIN EN ISO 9001: Qualitätsmanagementsysteme für Unternehmen
- ISO 27001: Informationssicherheits-Managementsystem (ISMS) und IT-Sicherheit
roXtra unterstützt Sie mit folgenden Lösungen
Wir zeigen Ihnen roXtra in einer kostenlosen und unverbindlichen Online-Präsentation.








